Значение герпесвирусов в постковидном периоде у детей / Савенкова М.С., Сотников И.А., Афанасьева А.А., Афанасьева Я.В., Душкин Р.В.
- острый COVID-19 (симптомы, длящиеся до 4 нед.);
- продолжающийся симптоматический COVID-19 (симптомы, продолжающиеся от 4 до 12 нед.);
- постковидный синдром (симптомы, длящиеся свыше 12 нед., не объяснимые альтернативным диагнозом, способные меняться со временем, исчезать и вновь возникать, затрагивая многие системы организма).
В марте 2021 г. Московским городским научным обществом терапевтов был проведен опрос респондентов в закрытой группе Facebook «Нетипичный коронавирус» с целью определения длительности постковидного синдрома. В работе использовался автоматизированный опросник. Был опрошен 231 пациент, переболевший COVID-19 [цит. по 3]. По результатам опроса выявлена разная продолжительность постковидного синдрома: 1–2 мес. — 28 (12,1%) респондентов, 3–4 мес. — 79 (34,2%), 5–6 мес. — 91 (39,4%), 9–10 мес. — 21 (9,1%), 11–12 мес. — 12 (5,2%). В данной работе подробно описаны симптомы постковидного синдрома у взрослых с учетом международного опыта.
С момента появления COVID-19 накапливаются данные по клиническим особенностям его течения, осложнениям и отдаленным последствиям. Вирус SARS-CoV-2 вызывает нарушения практически во всех жизненно важных органах [4], поэтому лечением пациентов занимаются врачи разных специальностей.
Ранее в литературе уже описано обострение или присоединение герпетических вирусных инфекций (ГВИ) в постковидном периоде. Так, в работе Т.В. Соломай и соавт. [5] показано, что SARS-CoV-2 является триггерным фактором, запускающим в организме человека механизм перехода вируса Эпштейна — Барр (ВЭБ) от фазы латенции к литической репродукции, а пациенты с COVID-19 составляют группу риска по реактивации хронической ВЭБ-инфекции. Было отмечено, что именно 2020 г. характеризовался выраженными изменениями внутригодовой динамики заболеваемости инфекционным мононуклеозом [5].
В обзорной статье Г.Х. Викулова [6] внимание исследователей было сфокусировано на случаях развития ГВИ, вызванной вирусом герпеса человека (ВГЧ) 1–3-го типов, мультисистемного воспалительного синдрома, неврологических нарушений, ассоциированных с реактивацией ВЭБ и ВГЧ-6 на фоне COVID-19. Авторами высказано предположение, что реактивация ВГЧ 1–3-го типов, ВЭБ, цитомегаловируса (ЦМВ) и ВГЧ-6 обусловлена иммуносупрессией, вызванной SARS-CoV-2.
В связи с постоянным обращением в консультативно-диагностический центр ГБУЗ «Морозовская ДГКБ ДЗМ» детей с постковидным синдромом после перенесенной SARS-CoV-2-инфекции было решено провести исследование, направленное на решение следующих вопросов:
-
Способствует ли СOVID-19 активации/реактивации ГВИ?
-
Каковы характерные жалобы пациентов?
-
Каковы основные клинические симптомы ГВИ?
-
Какие герпесвирусы наиболее часто выявляются у детей в настоящее время?
-
Выбор каких препаратов для лечения ГВИ в постковидном периоде предпочтителен?
Цель исследования: изучить частоту выявления подтвержденной ГВИ у детей, ранее перенесших COVID-19, особенности клинического течения заболевания в новых условиях (постковидный синдром) и обосновать тактику назначения лекарственной терапии.
Материал и методы
Наблюдательное проспективное исследование проводилось в условиях консультативно-диагностического центра ГБУЗ «Морозовская ДГКБ ДЗМ» с сентября 2021 г. по июль 2022 г.
Основными критериями включения пациентов в исследование были:
- дети в возрасте от 1 до 18 лет, перенесшие COVID-19;
- лабораторно подтвержденная ГВИ в настоящее время;
- как минимум двукратный осмотр в динамике наблюдения.
Критерии невключения:
- тяжелые хронические инфекционные и соматические заболевания (бронхиальная астма, сахарный диабет, лейкозы острые и хронические, туберкулез, ВИЧ-инфекция);
- возраст детей до 1 года.
В соответствии с критериями отбора из 456 проконсультированных за указанный период больных было отобрано 72 (15,8%) ребенка (42 мальчика и 30 девочек), которые ранее перенесли SARS-CoV-2-инфекцию, подтвержденную серологическим методом или с помощью полимеразной цепной реакции (ПЦР), и у которых при серологическом обследовании были выявлены вирусы герпеса. Детям было проведено комплексное обследование, в которое входило также микробиологическое исследование с посевом микрофлоры из зева и исключение внутриклеточных инфекций.
Диагноз ГВИ (ВГЧ-1, ВГЧ-2, ВЭБ, ЦМВ, ВГЧ-6) устанавливали с помощью иммуноферментного анализа и ПЦР (слюны, мочи и крови).
Статистическая обработка данных проводилась при помощи актуальной версии онлайн-инструмента электронных таблиц Google Spread Sheets.
Результаты и обсуждение
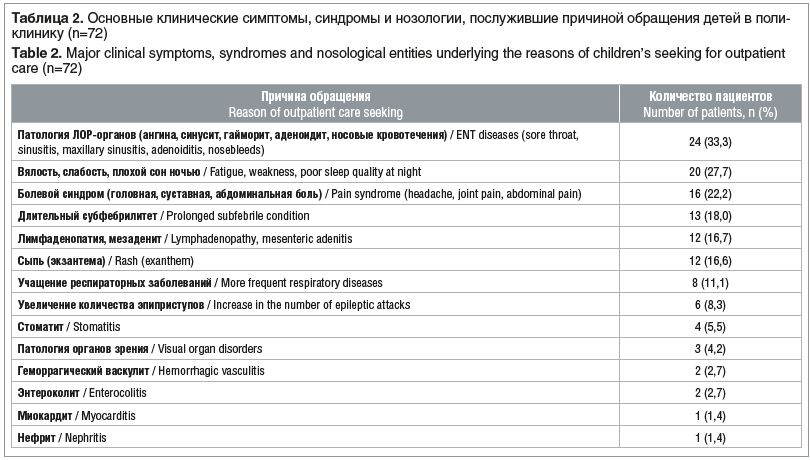
Распределение детей, включенных в исследование, по возрасту было следующим: 1–3 года — 12 (16,7%) детей, от 3 до 6 лет — 22 (30,6%), 6–9 лет — 14 (19,4%), 9–12 лет — 10 (13,9%), 12–15 лет — 9 (12,5%), 15–18 лет — 5 (6,9%). Из 72 детей однократно перенесли COVID-19 66 (91,7%) детей, дважды — 6 (8,3%), причем между двумя эпизодами прошло от 4 до 8 мес. Большинство детей обратились в поликлинику с жалобами в первые 2 мес. после перенесенного COVID-19 (табл. 1). В целом 60 (81,9%) детей обратились с жалобами в течение первых 6 мес. после перенесенной инфекции, ассоциированной с SARS-CoV-2. Причины обращения за медицинской помощью при включении в исследование представлены в таблице 2.

По результатам этиологической диагностики были выявлены следующие герпесвирусы: ВЭБ — у 44 (61,1%) детей, ВГЧ-6 — у 41 (56,9%), ЦМВ — у 30 (41,7%), ВГЧ-1 и ВГЧ-2 — у 11 (15,3%). Герпесвирусное моноинфицирование выявлено у 41 (56,9%) ребенка, микст-инфицирование — у 31 (43,1%), причем комбинация двух вирусов была у 22 (71,0%) детей из 31, трех вирусов — у 6 (19,3%), четырех вирусов — у 3 (9,7%).
Обращает на себя внимание тот факт, что ведущим в этиологической структуре ГВИ в постковидном периоде был ВЭБ, довольно высока была доля ВГЧ-6 и ЦМВ.
Анализ анамнеза и выписок из амбулаторных карт и историй болезни обратившихся детей показал, что у 17 (23,6%) детей ГВИ диагностировали ранее, до COVID-19. Однако многие родители не придавали этому значения, не проводили лечения и контрольных анализов, что привело к обострению ГВИ в постковидном периоде.
В качестве примера приводим клиническое наблюдение, демонстрирующее особенность течения герпетической инфекции — ее активацию у ребенка, перенесшего COVID-19.
Клиническое наблюдение. Девочка М., 3 года. Родители обратились за консультацией в феврале 2022 г.
Из анамнеза: вся семья перенесла COVID-19 в мае 2021 г. Повторно все заболели респираторной инфекцией 14.01.2022, причем у отца — положительная ПЦР на SARS-CoV-2, у остальных членов семьи — отрицательная. 19.01.2022 у ребенка развился острый обструктивный ларинготрахеит (синдром крупа), девочка была госпитализирована в стационар, где проводилось симптоматическое лечение. 24.01.2022 у ребенка появилась мелкоточечная сыпь с единичными везикулами на лице, ладонях и стопах, а также везикула на правой миндалине.
Анамнез жизни: страдает атопическим дерматитом, перенесла розеолу (ВГЧ-6) в возрасте 6 мес.
При обследовании на SARS-CoV-2 обнаружен высокий титр антител — 1725 BAU/мл, на ВГЧ-6 — положительные IgG (6,5 у. е.), положительная ПЦР в образцах слюны и сыворотке крови. Ребенку был назначен иммуностимулирующий препарат с противовирусной активностью инозин пранобекс (сироп Гроприносин®-Рихтер, ОАО «Гедеон Рихтер», Венгрия) и симптоматическое лечение воспаления ротоглотки. На фоне проводимой терапии состояние ребенка быстро улучшилось, купировались клинические симптомы. Рекомендовано динамическое наблюдение с контрольными анализами на герпесвирусы (ПЦР, серологические исследования).
По результатам микробиологического обследования у 13 (18%) пациентов наряду с герпесвирусами выявлена патогенная микрофлора: золотистый стафилококк, гемофильная палочка, стрептококки, у 10 (13,9%) — внутриклеточные возбудители.
Наш опыт и результаты настоящего исследования позволили нам предположить следующий патогенез развития указанных состояний (см. рисунок).
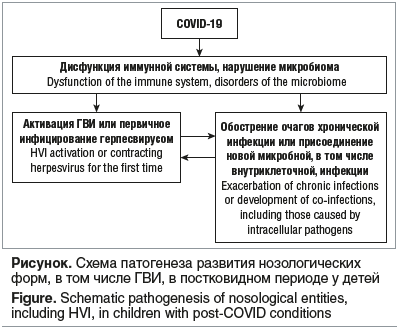
Иммунная дисрегуляция в постковидном периоде у больных сопровождается выраженным дисбалансом иммунного статуса и активацией ГВИ (ВГЧ 1–3-го типов, ВЭБ, ЦМВ, ВГЧ-6), присоединением бактериальных инфекций, грубыми изменениями микробиома [7]. Это обстоятельство требует от практикующих врачей ведения пациентов в постковидном периоде с учетом высокого риска развития смешанных вирусно-бактериальных или сочетанных ГВИ, назначения диагностических методов и лечебных мероприятий.
При анализе данных, представленных в таблице 1, резонно возникает вопрос: какие из клинических проявлений настоящего заболевания относятся к ГВИ, а какие — к обострению бактериальных очагов хронической инфекции? Скорее всего, формируется порочный круг, когда ГВИ в силу иммуносупрессии способствует активации вторичной микробной флоры и внутриклеточных инфекций, и наоборот. Такие симптомы, как сыпь (12 (16,6%) детей), стоматит (4 (5,5%)) и поражение органа зрения в виде кератита (1 (1,4%)), хориоретинита (1 (1,4%)) и блефарита (1 (1,4%)), были обусловлены только вирусами герпеса и четко подтверждены лабораторными методами. Инфицирование вирусами герпеса или активация хронической ГВИ также способствовали возникновению длительного субфебрилитета или периодическим подъемам температуры до фебрильных цифр, слабости, плохому ночному сну.
Одной из причин обращения к врачу была патология ЛОР-органов — 24 (33,3%) случая, из них ангина — 8 случаев, гайморит — 4, синусит — 3, аденоидит — 3, паратонзиллярный абсцесс — 1, носовые кровотечения — 5. Интерес представляет довольно большое количество ангин, которые имели смешанную герпетическую этиологию (ВЭБ + другие ГВИ + бактериальная микрофлора). Лимфаденопатия и мезаденит у детей были связаны с активацией ВЭБ и ЦМВ.
У 6 (8,3%) детей с фокальной эпилепсией было отмечено увеличение количества эпилептических приступов, связанных лечащим врачом с активацией имеющейся ГВИ, причем большинство из них объяснялось активацией ВГЧ-6.
Миокардит у 1 (1,4%) ребенка 11 мес. был обусловлен ЦМВ-инфекцией, девочка была госпитализирована для лечения в стационар.
У 1 (1,4%) девочки 13 лет с интерстициальным нефритом было выявлено течение острой микоплазменной инфекции и обострение ВЭБ-инфекции, она также была госпитализирована в стационар.
Терапия детей с ГВИ в постковидном периоде представляет собой сложную задачу, поскольку наличие нескольких герпесвирусов, их сочетание с патогенной микрофлорой требуют комплексного подхода. В таблице 3 представлены лекарственные препараты, которые применялись врачами после получения результатов обследования детей.

Из препаратов с антигерпетическим действием врачи наиболее часто назначали инозин пранобекс (Гроприносин®) и ациклические нуклеозиды. Гроприносин® относится к противовирусным препаратам широкого спектра действия, который применяется при гриппе, острых респираторных вирусных инфекциях, COVID-19, а также при всех ГВИ (ВГЧ 1–3-го типов, ЦМВ, ВЭБ, ВГЧ-6). Иммуномодулирующий эффект препарата связан с воздействием на Т- и В-клеточное звено (увеличение синтеза антител и усиление пролиферации лимфоцитов), влиянием на цитокиновый профиль (усиление синтеза интерлейкинов 1 и 2, интерферона γ), а также повышением функциональной активности клеток врожденного иммунитета. Стимуляция Т-лимфоцитов под влиянием инозина пранобекса является ключевым фактором успешной борьбы с вирусными инфекциями, включая SARS-CoV-2, а ранняя активация Т-лимфоцитов может предопределять течение и исход заболевания [7]. В лечении 6 детей с учащением приступов фокальной эпилепсии в постковидном периоде вследствие активации ВГЧ-6 препаратом выбора стал инозин пранобекс, так как ранее [8] было показано, что его назначение способствовало сокращению числа эпиприступов (по данным ЭЭГ) на 50–55,6%. Хороший эффект комбинированного лечения ГВИ описан при одновременном назначении препаратов инозина пранобекса и/или ацикловира с меглюмина акридонацетатом или использованием ректальных свечей интерферона альфа-2b[9, 10].
Антибактериальные препараты назначали преимущественно с целью терапии внутриклеточных инфекций. Принимая во внимание возможность длительного и волнообразного течения инфекции, а также нарушение микробиоценоза не только полости рта, но и кишечника, детям назначали пробиотические средства.
Пациентов, которые перенесли COVID-19 и имеют обострение герпесвирусной или вирусно-бактериальной инфекции, следует рассматривать как больных с вторичным иммунодефицитом. С целью иммунорегуляции нарушенных звеньев иммунитета и для профилактики повторных респираторных инфекций в данном случае оправдано назначение инозина пранобекса (Гроприносин®). Иммуномодулирующий эффект инозина пранобекса основан на активации системы комплемента, повышении синтеза эндогенного интерферона α/β и усилении гуморального иммунного ответа (повышение синтеза антител) [11–13]. Имея двойной механизм противовирусного действия (подавление репликации ДНК- и РНК-вирусов и активация противовирусного иммунитета), Гроприносин® не обладает антигенностью, не вызывает передозировки и гиперстимуляции иммунитета (обеспечивает физиологичный иммунный ответ) и может использоваться пациентами всех возрастных групп, начиная с 3 лет [11].
По усмотрению врача в терапию ГВИ в постковидном периоде добавляли пидотимод (на 1–2 мес.) и альфа-глутамил-триптофан (в виде спрея интраназального). Из антибактериальных препаратов чаще назначали группу макролидов, преимущественно с целью терапии внутриклеточных инфекций (см. табл. 2).
Принимая во внимание персистирующий характер ГВИ, длительное, волнообразное течение инфекционного процесса, развитие дисбиоза как в полости рта, так и в кишечнике, детям назначали различные пробиотики. Желательно рекомендовать те средства, которые содержат пробиотические штаммы с доказанной эффективностью и могут применяться у детей с периода новорожденности, способствуя поддержанию баланса кишечной микрофлоры. Нежелательных реакций на фоне назначенной терапии зарегистрировано не было.
Заключение
Таким образом, перенесенная инфекция, вызванная SARS-CoV-2, по нашим данным, способствует активации герпетических инфекций в отдаленном (постковидном) периоде у 15,8% больных. Данное обстоятельство важно иметь в виду практикующим врачам для более ранней диагностики и начала соответствующего лечения.
Из группы герпесвирусов в постковидном периоде наиболее часто выявляли ВЭБ — у 61,1% обследованных. Именно наличие ГВИ обусловило появление жалоб (длительный субфебрилитет, вялость и плохой сон, наличие высыпаний, лимфаденопатия, учащение респираторных заболеваний и т. д.) и стало причиной обращения в поликлинику, как правило, в течение первых 6 мес. после перенесенного СOVID-19.
Моноинфекция, обусловленная герпесвирусом, обнаружена у более половины (41 (56,9%)) детей, микст-инфицирование вирусами герпеса разных типов — у 31 (43,1%) ребенка. Наряду с герпесвирусами была выявлена патогенная микрофлора у 18% пациентов, в том числе внутриклеточные возбудители определялись у 13,9% из 72 детей. Наличие смешанной вирусно-бактериальной инфекции требует назначения препаратов с антигерпетической и иммуномодулирующей активностью, антибактериальных препаратов, а также пробиотиков для нормализации иммунного статуса и микробиоты ребенка.
Сведения об авторах:
Савенкова Марина Сергеевна — д.м.н., профессор кафедры клинической функциональной диагностики факультета дополнительного профессионального образования РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; врач-педиатр КДЦ ГБУЗ «Морозовская ДГКБ ДЗМ»; 119049, Россия, г. Москва, 4-й Добрынинский пер., д. 1/9; ORCID iD 0000-0002-1648-8683.
Сотников Илья Александрович — к.м.н., заведующий КДЦ ГБУЗ «Морозовская ДГКБ ДЗМ»; 119049, Россия, г. Москва, 4-й Добрынинский пер., д. 1/9.
Афанасьева Аида Алимовна — к.м.н., ассистент кафед-ры клинической функциональной диагностики факультета дополнительного профессионального образования РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; врач-педиатр КДЦ ГБУЗ «Морозовская ДГКБ ДЗМ»; ORCID iD 0000-0001-5328-4877.
Афанасьева Яна Владимировна — академический советник Общероссийской общественной организации «Российская инженерная академия»; 125009, Россия, г. Москва, Газетный пер., д. 9, стр. 4.
Душкин Роман Викторович — директор по науке и технологиям ООО «АИИ»; 127591, Россия, г. Москва, ул. Дубнинская, д. 75б, стр. 2; ORCID iD 0000-0003-4789-0736.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
About the authors:
Marina S. Savenkova — Dr. Sc. (Med.), Professor of the Department of Clinical Functional Diagnostics of the Faculty of Additional Professional Education, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; pediatrician, Consultative and Diagnostic Center "Morozov Children's City Clinical Hospital"; 1/9, 4th Dobryninsky proezd, Moscow, 119049, Russian Federation; ORCID iD 0000-0002-1648-8683.
Ilya A. Sotnikov — C. Sc. (Med.), Head of Consultative and Diagnostic Center "Morozov Children's City Clinical Hospital"; 1/9, 4th Dobryninsky proezd, Moscow, 119049, Russian Federation.
Aida A. Afanasieva — C. Sc. (Med.), assistant of the Department of Clinical Functional Diagnostics of the Faculty of Additional Professional Education, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0001-5328-4877.
Yana V. Afanasieva — Academic advisor of the All-Russian Public Organization "Russian Academy of Engineering"; 9, bldn. 4, Gazetny per., Moscow, 125009, Russian Federation.
Roman V. Dushkin — Director for Science and Technologies, LLC "Agency of Artificial Intelligence"; 75b, bldn. 2, Dubninskaya str., Moscow, 127591, Russian Federation; ORCID iD 0000-0003-4789-0736.
2. Баймухамбетова Д.В., Горина А.О., Румянцев М.А. и др. Постковидное состояние у взрослых и детей. Пульмонология. 2021;31(5):56–570. DOI: 10.18093/0869-0189-2021-31-5-562-570.
3. Рекомендации по ведению больных с коронарной инфекцией COVID-19 в острой фазе и при постковидном синдроме в амбулаторных условиях. Под ред. проф. Воробьева П.А. Проблемы стандартизации в здравоохранении. 2021;7–8:3–96. DOI: 10.26347/1607-2502202107-08003-096.
4. Амиров Н.Б., Давлетшина Э.И., Васильева А.Г., Фатыхов Р.Г. Постковидный синдром: мультисистемные «дефициты». Вестник современной клинической медицины. 2021;14(6):94–104. DOI: 1020969/VSKM.2021.14(6).94-104.
5. Соломай Т.В., Семененко Т.А., Исаева Е.И. и др. COVID-19 и риск реактивации герпесвирусной инфекции. Эпидемиология и инфекционные болезни. Актуальные вопросы. 2021;11(2):55–62. DOI: 10.18565/epidem.2021.11.2.55-6.
6. Викулов Г.Х., Орадовская И.В. Клинико-иммунологические особенности СOVID-19, ассоциированной с герпесвирусными инфекциями человека: алгоритмы ведения сочетанных инфекций. Инфекционные болезни. 2021;19(4):79-90. DOI: 10.20953/1729-9225-2021-4-79-90.
7. Votava M., Beran J. The role of non-specific immunostimulant inosine pranobex in the treatment of SARS-CoV-2 virus infection (Electronic resource.) URL: https://www.researchgate.net/publication/341043129_The_role_of_non-specific_immunostimulant_inosine_pranobex_in_the_treatment_of_SARS-CoV-2_virus_infection (access date: 04.2020).
8. Савенкова М.С., Балакирева Г.М., Кузнецова Е.С. и др. Опыт лечения препаратом Гроприносин (инозином пранобексом) герпесвирусных инфекций у детей с эпилепсией и детским церебральным параличом. Педиатрия. Consilium Medicum. 2019;4:51–57. DOI: 10.26442/26586630.2019.4.190750.
9. Митрофанов А.В., Гасилина Е.С., Китайчик С.М. и др. Сравнительная эффективность противовирусной терапии инфекционного мононуклеоза у детей. Практическая медицина. 2012;7-1(63):63.
10. Савенкова М.С., Афанасьева А.А., Балакирева Г.М. и др. Клинический опыт лечения заболеваний дыхательных путей препаратом Гроприносин (инозин пранобекс) в педиатрической практике. Педиатрия (прил. к журн. Consilium Medicum). 2018;4:32–6. DOI: 10.26442/24138460.2018.4.180112.
11. Исаков Д.В., Исаков В.А., Алексеева Е.А. Иммуномодуляторы в терапии и профилактике респираторных и герпесвирусных инфекций. Клиническая фармакология и терапия. 2018;27(5):76–84. DOI: 10.32756/0869-5490-2018-5-76-84.
12. Looker K.J., Magaret A.S., May M.T. Global and regional estimates of prevalent and incident Herpes simplex virus type 1 infections in 2012. PLoS One. 2015;10(10):e0140765. DOI: 10.1371/journal.pone.0140765.
13. Masihi K.N. Immunomodulatory agents for prophylaxis and therapy of infections. Int J Antimicrob Agents. 2000;14(3):181–191. DOI: 10.1016/s0924-8579(99)00161-2.
Оригинал
